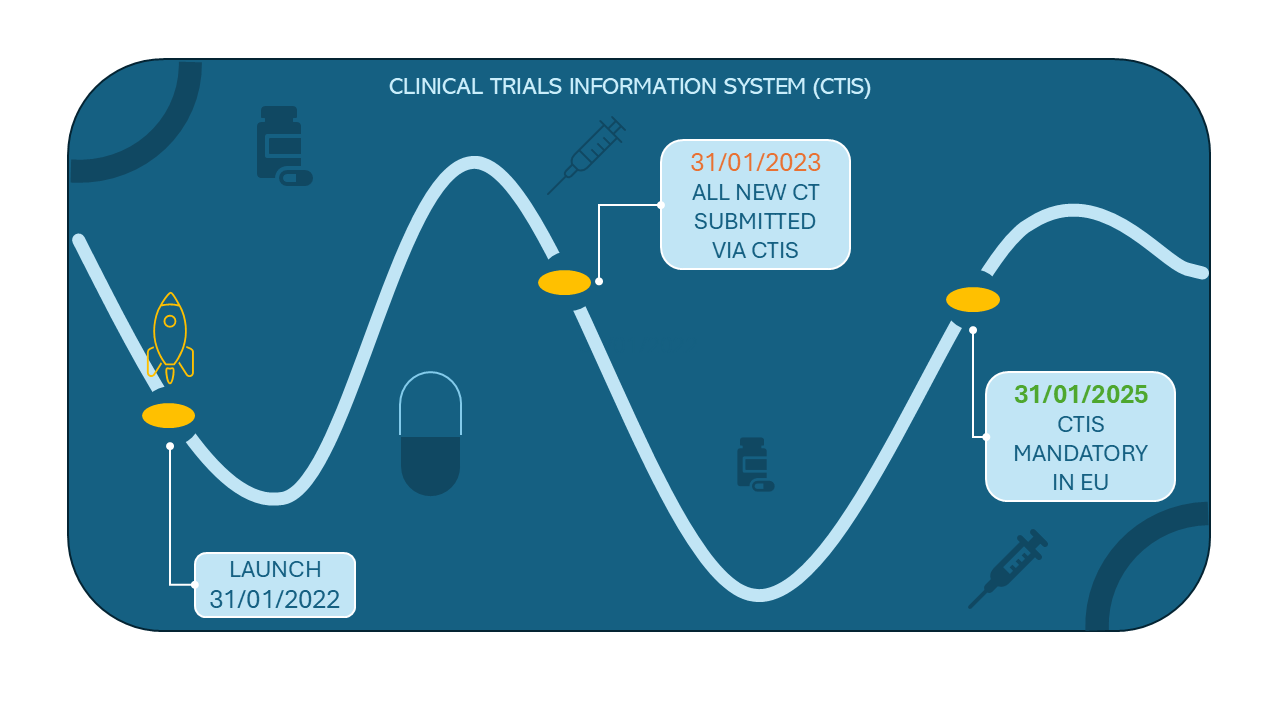
Informační systém klinických studií (CTIS) v plném provozu
CTIS byl zřízen farmaceutickým zákonem v rámci Nařízení o klinických studiích (Nařízení (EU) č. 536/2014) a k 30. lednu 2025 kompletně nahradil původní systém pro klinické studie EudraCT.
CTIS se tak stává jediným systémem správy klinických hodnocení v EU.
Na konci ledna tak bylo ukončeno tříleté přechodné období, během kterého bylo více než 5 000 klinických studií převedeno do nového prostředí.
Povolování a dohled nad klinickými hodnoceními je stále odpovědností členských států EU/EHP, zatímco EMA odpovídá za udržování CTIS. Evropská komise pak dohlíží na provádění nařízení o klinickém hodnocení.
CTIS obsahuje i výstup pro zdravotnické pracovníky, pacienty a širokou veřejnost, aby byla zajištěna vysoká úroveň transparentnosti, kterou předpokládá nařízení.
V průběhu roku 2025 se bude CTIS i nadále vylepšovat na základě uživatelských zkušeností. EMA zároveň pokračuje v pořádání školících programů pro uživatele a sponzory klinických hodnocení.
Plná implementace nařízení o klinických studiích posiluje Evropu jako atraktivní místo pro klinický výzkum. Nařízení zefektivňuje procesy pro podávání a dohled nad klinickými hodnoceními a jejich veřejnou registraci: všichni zadavatelé klinických hodnocení používají stejný systém a postupují podle stejných postupů při žádosti o povolení klinického hodnocení, bez ohledu na to, kde se nacházejí a se kterou vnitrostátní institucí nebo národní etickou komisí jednají.
Schéma přechodu na nový informační systém pro klinická hodnocení